REAKSI SUBSTITUSI NUKLEOFILIK SN2
A. Reaksi Substitusi Nukleofilik
Reaksi substitusi nukleofilik suatu nukleofil (Z
:) menyerang alkil halida pada atom karbon hibrida-sp3 yang mengikat halogen (X), menyebabkan terusirnya halogen oleh nukleofil. halogen yang terusir disebut gugus pergi. Nukleofil harus mengandung pasangan elektron bebas yang mengandung pasangan elektron bebas yang digunakan untuk membentuk ikatan baru dengan karbon. hal ini memungkinkan gugus pergi terlepas dengan membawa pasangan elektron yang tadinya sebagai elektron ikatan. Ada dua persamaan umum yang dapat dituliskan:

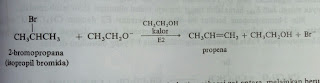
Contoh masing-masing reaksi adalah:

Mekanisme reaksi substitusi nukleofilik pada dasarnya terdapat dua mekanisme reaksi substitusi nukleofilik. Mereka dilambangkan dengan SN2 dan SN1 menunjukan substitusi nukleofilik, sedangkan arti 1dan 2 akan dijelaskan kemudian.
Reaksi SN2
Mekanisme SN2 adalah proses suatu tahap yang dapat digambarkan sebagai berikut;

Nukleofil menyerang dari belakang ikatan C-X. Pada keadaan transisi, nukleofil dan gugus pergi bearsosiasi dengan karbon dimana substitusi akan terjadi, pada saat gugus pergi terlepas dengan membawa pasangan elektron, nukleofil memberikan pasangan elektronnya untuk dijadikan pasangan elektron karbon. Notasi 2 menyatakan bahwa reaksi adalah bimolekuler, yaitu nukleofil dan substrat terlibat dalam langkah penentu kecepatan reaksi dalam mekanisme reaksi. tahapan reaksi substitusi nukleofilik bimolekuler, SN2.
Mekanisme reaksi SN2 hanya terjadi pada alkil halida primer dan sekunder. Nukleofil yang menyerang adalah adalah jenis nukleofil kuat seperti -OH, -CN, CH3O. Serangan dilakukan dari belakang. Untuk lebih jelas, perhatikan contoh reaksi mekanisme SN2 bromoetana dengan ion hidroksida berikut ini
Bila sebuah nukleofil menabrak sisi belakang suatu atom karbon tetrahedral yang terikat pada sebuah halogen, dua peristiwa tersebut terjadi sekaligus:(1) suatu ikatan baru mulai terbentuk, dan (2)
ikatan C-X mulai patah. Proses ini disebut proses serempak. jika energi potensial kedua spesi yang bertabrakan cukup tinggi, tercapai suatu titik dimana, dilihat dari segi energi, pembentukan ikatan baru dan pematahan ikatan C-X lama dimudahkan. Ketika pereaksi diubah menjadi produk, mereka harus melewati suatu keadaan antara, yang memiliki energi potensial tinggi, dibandingkan dengan energi pereaksi atau produk. Keadaan antara ini disebut
keadaan transisi (
activated complex). Karena keadaan kedaan transisi melibatkan dua partkel (Nu- RX ), maka reaksi SN2 dikatakan bersifat
bimolekular (
bimolecular : angka 2 dalam SN2 menyatakan bimolekular).
Suatu keadaan transisi dalam reaksi apa saja adalah penataan yang berenergi tinggi dan sekilas dari pereaksi ketika berubah menjadi produk. Suatu keadaan darransisi hanyalah suatu pemberian dari molekul dalam keadaan berubah. Akan sering digunakan tanda kurung siku dalam persamaan reaksi, untuk menunjukan struktur sementara yang tak dapat diiusolasi, dalam reaksi itu. Disini tanda kurung siku digunakan terhadap struktur suatu keadaan transisi. Kelak tanda kurung ini digunakan untuk menyatakan produk-produk tak stabil, yang bereaksi lebih lanjut.
Untuk reaksi SN2 itu, keadaan transisi mencakup suatu rehibidasi sementara dari atom karbon ujung dari sp3 ke sp2 dan akhirnya kembali ke sp3 lagi. Dalam keadaan transisi itu, atom karbon tersebut mempunyai tiga ikatan sp2 dapat ditambahkan dua setengah ikatan yang menggunakan orbital p.
Ketika nukleofil menyerang dari arah belakang molekul ketiga gugus yang terikat pada karbon berubah posisi menjadi rata-rata dalam keadaan transisi, kemudin membalik ke sisimlain, sangat mirip dengan payung yang kelewatan terbukanya. Peristiwa membalik ini disebut inversi konfigurasi atau inversi Walden.
Adanya sebagai bagian mekanisme suatu reaksi SN2 diperagakan dengan indahnya, oleh
reaksi enantioner murni dari alkil halida sekunder kita. Misalnya, reaksi SN2 dari (R)-2-bromooktana dengan -OH menghasilkan (S)-oktanol secara hampir eksklusif.

Kebanyakan reaksi yang melibatkan molekulkiral dilaksanakan dengan campuran rasenik, yakni campuran ekuimolar reaktan (R) dan (S). Dalam hal-hal ini produk juga berupa campuran rasemik. Meskipun terjadi inversi, efek ini tak dapat diamati karena separuh molekul-molekul menuju ke satu arah dan separuh lainnya menuju kearah yang berlawanan.
Sumber:
Fessenden,Ralph J., 1986, Kimia Organik, Jakarta: Erlangga
Hart, Craine., 2003, Kimia Organik, Jakarta: PT Gelora Aksara Pratama
Permasalahan:
Berdasarkan artikel diatas saya mendapatkan beberapa masalah sebagai berikut:
1. Dari artikel diatad kita dapat mengetahui bahwa bahwa reaksi mekanisme SN2 menghasilkan produk berupa inversi (terbalik) yang dikenal sebagai inversi. Oleh karena itu saya mau bertanya, apa yang menyebabkan terjadinya fenomena "inversi" ini?
2. Bagaimana kita dapat mengetahui bahwa dalam suatu reaksi terjadinya reaksi SN2?
3. Mengapa mekanisme reaksi SN2 hanya terjadi pada alkil halida primer dan sekunder?
Mohon bantuannya teman-teman sekalian, terimakasih.